PRESENTACIÓN DE CASOS
Hidatidosis vertebral intrarraquídea.
Una patología médico-quirúrgica
Reporte de dos casos
Francisco J. Sánchez Villanueva,* Sebastián López Barbieri,** Francisco Adriazola Gallardo#
* Servicio de Traumatología, Servicio de Urgencia, Hospital Base San José de Osorno, Osorno, Chile
** Servicio de Traumatología, Equipo de Columna, Hospital Clínico de la Universidad de Chile, Santiago de Chile, Chile
# Servicio de Traumatología, Equipo de Columna, Hospital Base Valdivia, Valdivia, Chile
Dr. Francisco J. Sánchez Villanueva • fsanvil@gmail.com https://orcid.org/0000-0002-5868-5001
ORCID de S. López Barbieri: http://orcid.org/0000-0001-8033-3128
ORCID de F. Adriazola Gallardo: http://orcid.org/0000-0001-9415-9909
https://doi.org/10.15417/issn.1852-7434.2020.85.1.874
Recibido el 26-6-2018.
Aceptado luego de la evaluación el 14-5-2019
Resumen
La hidatidosis es una enfermedad causada por el estado larval del platelminto Echinococcus, cuya especie más prevalente
es Echinococcus granulosus. Se trata de un cuadro endémico en Eurasia, África, Australia y Sudamérica. En Chile, tiene una
incidencia notificada de 2,1 casos por 100.000 habitantes y, pese a estar asociada a las zonas ganaderas del sur del país, se
detecta en todo el territorio debido al desplazamiento de la población y a su largo período de incubación. Se caracteriza por la
presencia de un quiste habitualmente en el hígado (75%) o los pulmones (15%). La afectación de otros sitios es menos frecuente
y el compromiso óseo es raro, no supera el 1-2,5%, ya sea en el tejido trabecular o el canal medular. El tratamiento, en general,
es médico-quirúrgico con resultados clínicos dispares debido a la alta tasa de recurrencias y las secuelas. La experiencia en el
manejo de pacientes con hidatidosis intrarraquídea es limitada a causa de su baja frecuencia. Por este motivo, quisimos reportar
dos casos atendidos en nuestro centro y analizar su manejo.
Palabras clave: Hidatidosis; Intrarraquídea; Espinal; Echinococcus.
Nivel de Evidencia: IV
Abstract
Hydatid disease of the vertebrae with intraspinal involvement. A medical and surgical disease.
A two-case report
Hydatidosis is a disease caused by the larval stage of Echinococcus, the most prevalent species being Echinococcus granulosus.
Hydatidosis is endemic to Eurasia, Africa, Australia and South America. In Chile, it has a reported incidence of 2.1 cases per
100,000 inhabitants and, although it is associated with the livestock areas of southern Chile, there have been reports throughout
the territory due to the displacement of the population and its long incubation period. It is characterized by the presence of a cyst
usually at the hepatic (75%) or pulmonary (15%) level. The involvement of other regions is less common and bone involvement is
a rarity that does not exceed a 1-2.5% prevalence, either in the trabecular tissue or spinal canal. A combined medical and surgical
approach is the most common treatment which involves disparate clinical outcomes due to the high rate of recurrences and sequelae.
Experience in the management of patients with intraspinal hydatidosis is limited because of their low frequency. Therefore,
we wanted to report 2 cases treated in our center and to analyze the progress in its management.
Key words: Hydatidosis; Intraspinal; Spine; Echinococcus.
Level of Evidence: IV
Introducción
La hidatidosis es una enfermedad causada por el estado larval del platelminto Echinococcus, la especie más
prevalente es Echinococcus granulosus. Es endémica en Eurasia, África, Australia y Sudamérica. Esta zoonosis
parasitaria se adquiere por la ingestión de huevos de E. granulosus excretados en las deposiciones del perro, que
contaminan el agua o los alimentos, o que están presentes en su pelaje. El ciclo de transmisión se establece habitualmente
en relación con la crianza de ganado ovino o caprino, el que desarrolla la infección como huésped intermediario
con quistes viscerales y el ciclo se perpetúa por su uso en la alimentación del perro luego del sacrificio
del ganado. El hombre es un huésped accidental intermediario en este ciclo.1,2 En Chile, la incidencia notificada es
de 2,1 casos por 100.000 habitantes y, pese a que está asociada a las zonas ganaderas del sur del país, se detecta en
todo el territorio debido al desplazamiento de la población y a su largo período de incubación. Se caracteriza por la
presencia de un quiste habitualmente en el hígado (75%) o los pulmones (15%) que puede provocar síntomas, en
algunos pacientes, por ocupación de tejidos circundantes o sus complicaciones. La afectación de otros territorios
es menos frecuente y el compromiso óseo es raro, no supera el 1-2,5%, ya sea en el tejido trabecular o el canal
medular.3
En la Región de Los Ríos, la incidencia promedio es de 6,1 por 100.000 habitantes; la tasa de mortalidad, de 0,1
por 100.000 y la tasa de letalidad, del 1,3%.4
La experiencia en el manejo de pacientes con hidatidosis intrarraquídea es limitada debido a su baja frecuencia.
Por este motivo, comunicamos dos casos atendidos en nuestro centro y analizamos su complicado manejo.
Caso clínico 1
Paciente de 80 años, en la actualidad, con antecedentes de hipertensión arterial y diabetes mellitus tipo 2. Originario
de la zona endémica del sur de Chile. Tiene diagnóstico de hidatidosis hepática, en control por cirugía digestiva,
de larga data. En 1990, es operado por una masa abdominal retroperitoneal que fue resecada en bloque. En el
protocolo operatorio, se describe un quiste a nivel de L4 que se reseca por completo y múltiples quistes en relación
con el psoas ilíaco. Sin registro de tratamiento antiparasitario. Luego de la cirugía, evoluciona con debilidad motora
en la cara anterior del muslo izquierdo, con compromiso sensitivo. Se interpreta como lesión intraoperatoria
del nervio crural izquierdo.
En 1995, acude a controles por una uropatía obstructiva. En la tomografía computarizada de control, se observan
múltiples quistes retroperitoneales. El paciente no acude a los controles y al seguimiento hasta 2002, cuando es
revaluado por cirugía digestiva.
Es operado nuevamente en agosto de 2003 por un quiste hidatídico abdominal. Las molestias y el dolor neuropático
en el muslo izquierdo persisten. Durante la cirugía, se detecta un quiste de, al menos, 20 cm de diámetro
mayor, que se drena y se reseca en bloque. Se envía una muestra a anatomía patológica y el informe indica quiste
hidatídico. En el posoperatorio, se inicia tratamiento con albendazol 400 mg, cada 12 h, en 8 ciclos de 28 días, con
períodos de 15 días de descanso entre ellos.
En 2008, se detectan quistes retroperitoneales múltiples y un quiste hidatídico del psoas. Persiste el dolor de
tipo neuropático, invalidante, y el paciente necesita bastones para deambular. Además, tiene incontinencia vesical
y anal, y disfunción eréctil. La resonancia magnética muestra compromiso vertebral de L2-L3, con imágenes
quísticas paravertebrales izquierdas sugerentes de hidatidosis asociada a una estenosis raquídea por espondiloartrosis
de L3-S1, además de compromiso hidatídico intrarraquídeo, lo que explica la sintomatología neurológica
(Figura 1).
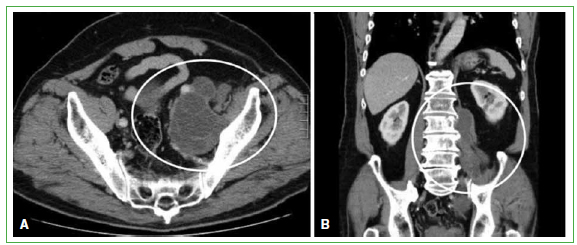
Figura 1. Tomografía computarizada de abdomen y pelvis. A. Corte transversal. Masa lobulada intrapelviana en relación
con el psoas ilíaco izquierdo, de aproximadamente 14 cm de largo. B. Corte coronal. Masa lobulada en relación con L1-L2
y L3 izquierda. (Año 2008).
El paciente queda hospitalizado para evaluación, con diagnóstico de síndrome de cauda equina secundaria a
hidatidosis intrarraquídea. En octubre de 2008, los médicos del Servicio de Neurocirugía extirpan el quiste hidatídico.
Además, se efectúa una laminectomía de L3 y una facetectomía parcial medial de L3 y L4 izquierda, con gran
compresión de raíces. Se realiza punción y posteriormente se reseca todo el quiste. A los 28 días de la cirugía, se
administran ciclos de albendazol 400 mg, cada 12 h, con 15 días de descanso entre los ciclos, por 6 meses.
En 2010, es evaluado en el Servicio de Traumatología por dolor lumbar crónico. Se detecta dolor radicular
lumbar alto izquierdo. En las imágenes de control, se observan lesiones líticas de cuerpos vertebrales de L2 a L4
(Figura 2).
En abril de 2010, se realiza una nueva laminectomía descompresiva, exponiendo un gran quiste hidatídico principal
de más de 12 cm de diámetro mayor, que se punza y se reseca completamente, pero se detectan múltiples
quistes intrarraquídeos. Se inicia tratamiento con albendazol 400 mg, cada 12 h, en ciclos de 28 días, con 15 días
de descanso entre ellos.
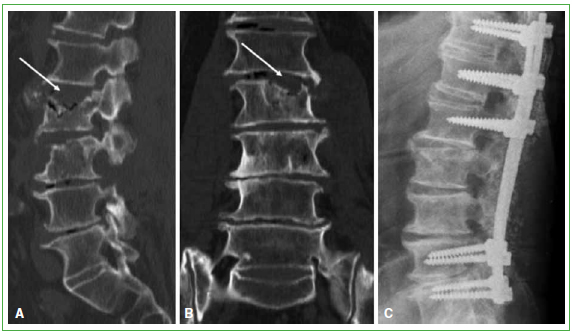
Figura 2. Tomografía computarizada de columna lumbar. A. Corte lateral. Lesiones líticas en la placa superior y el cuerpo
de L3 y L4. B. Corte coronal. Lesiones líticas en la placa superior y el cuerpo de L3 y L4. C. Radiografía de columna lumbar
lateral. Se observa el resultado de la instrumentación lumbar larga de T12-L1-L2-L5 y S1, realizada en noviembre de 2012.
En controles seriados, se detecta colapso vertebral de L2, L3 y L4, además de quistes hidatídicos en el músculo
psoas ilíaco, por lo que se decide realizar una instrumentación posterior larga.
En noviembre de 2012, se procede a una fijación posterior de T12-L5 con tornillos pediculares y a una laminectomía
amplia de L3-L4 (Figura 2).
El informe anatomopatológico indica tejido osteocartilaginoso, tejido adiposo y tejido muscular estriado sin
evidencia de recidiva de la enfermedad. Se reinicia el tratamiento con albendazol 400 mg, cada 12 h, en ciclos de
28 días, con descanso de 15 días, por 6 ciclos.
El paciente evoluciona de manera favorable, persiste la hipoestesia y tiene disminución de la fuerza de L4-S1,
fuerza M2-M3 e hipoestesia L1-L3. Sin compromiso de esfínteres. En la actualidad, acude a controles en policlínico
de traumatología, de manera irregular y su adherencia al tratamiento es baja (Figura 3). En el último control,
a fines de 2016, se detecta una nueva masa retroperitoneal que desplaza contenido abdominal. El paciente es derivado
a cirugía digestiva para continuar con el manejo y el tratamiento de la masa retroperitoneal.
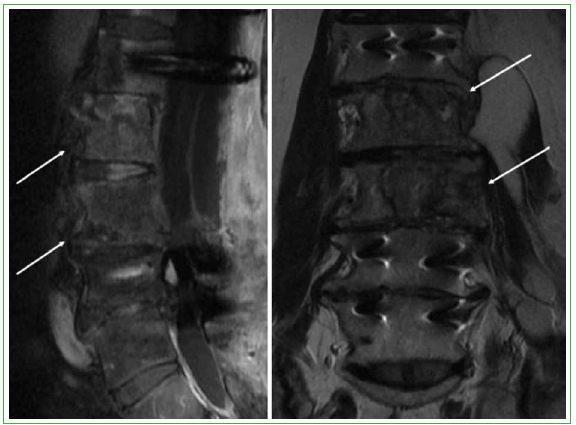
Figura 3. Resonancia magnética de columna lumbar, cortes coronal y sagital. Se observa compromiso lítico de cuerpos
vertebrales L2, L3 y L4. (Octubre de 2015).
Caso clínico 2
Paciente de 54 años, sin antecedentes mórbidos al comienzo del cuadro. Originario de una zona endémica del
sur de Chile. Consulta, en marzo de 2008, en el Servicio de Traumatología de un hospital cercano, por un cuadro
de dolor lumbar de 10 años de evolución, de carácter progresivo y persistente, asociado a una masa paravertebral
lumbar palpable, de consistencia gomosa de aproximadamente 10 x 4 x 3 cm. Se realiza una tomografía computarizada
que describe un proceso expansivo de partes blandas paravertebrales posteriores a derecha, con compromiso
erosivo de la articulación interapofisaria L4-L5. La resonancia magnética muestra un proceso expansivo
extrarraquídeo lumbar con extensión paravertebral y estenorraquis segmentaria de L4 a S1. Mide 14 x 6 x 5 cm
con lobulaciones y límites bien definidos. Se toma una muestra por punción y el informe indica: muestra constituida por fibras musculares normotípicas acompañadas de material mucoide y elementos inflamatorios crónicos que
incluyen células gigantes de tipo cuerpo extraño. El paciente es derivado al Hospital Base de Valdivia para continuar
con el estudio de la masa paravertebral lumbar (Figura 4).
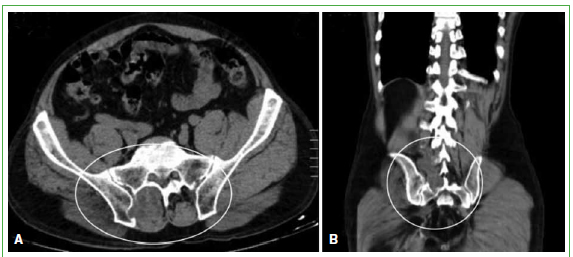
Figura 4. Tomografía computarizada de abdomen y pelvis. A. Corte transversal. Se observa una lesión paravertebral derecha
en relación con la articulación sacroilíaca. B. Corte coronal. Se visualiza una masa paravertebral de L4 a S1 derecha.
(Agosto de 2009).
En el examen físico al ingresar, se detecta la masa palpable descrita. Test de elongación con pierna extendida positivo
a derecha; paresia M4 en territorio L5 asociada a hipoestesia de L5. Una nueva resonancia magnética revela
una imagen compatible con lesiones quísticas extrarraquídeas en la región paravertebral, sin lesiones intrarraquídeas,
compatibles con hidatidosis. La tomografía computarizada de tórax, abdomen y pelvis no muestra lesiones
hepáticas ni pulmonares. Se realiza una prueba ELISA (IgG) para hidatidosis, cuyo resultado es no concluyente
(dos análisis consecutivos informados dudosos).
En enero de 2010, se efectúa la resección en bloque de las lesiones. Durante la toma de muestras, se observa
la ruptura de la cápsula de la lesión tumoral, que drena abundante líquido turbio, y material friable y de aspecto
cerebeloso. Se toman muestras vesiculares y se envían a anatomía patológica (Figura 5).
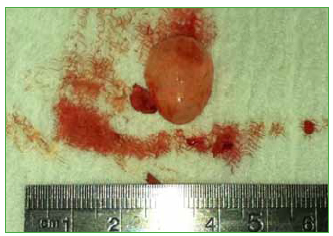
Figura 5. Lesión quística de 2 x 1,5 cm, correspondiente a quiste
hidatídico resecado en enero de 2010.
El informe de una biopsia rápida de tejido señala hidatidosis. Luego de la intervención, se inicia terapia con albendazol
400 mg, cada 12 h, en 2 ciclos de 28 días, separados por 14 días. No se evidencian cambios en el examen
neurológico tras la cirugía.
A fines de 2010, evoluciona con dolor y radiculitis severa de L5 y S1 a derecha y pérdida de fuerza M. En la
resonancia magnética de control, se observan múltiples lesiones quísticas intrarraquídeas en L4-S1, no detectadas
en resonancias previas; además, de daño articular L4-S1.
En abril de 2011, se lleva a cabo la fijación posterior de columna L4-S1 con tornillos pediculares asociado a descompresión
con hemilaminectomía de L4 y laminectomía de L5. Al abrir el canal medular se observan múltiples
quistes que comprimen el saco dural y las raíces L5 y S1 izquierdas. Se extraen los quistes y se procede al aseo
prolijo de la zona. Se administra albendazol 400 mg, cada 12 h, en 2 ciclos de 28 días. Después de la cirugía, persiste
el dolor radicular sin mejoría en las pruebas motoras ni sensitivas. La biopsia quirúrgica confirma la presencia
de estructuras compatibles con hidatidosis (Figura 6).
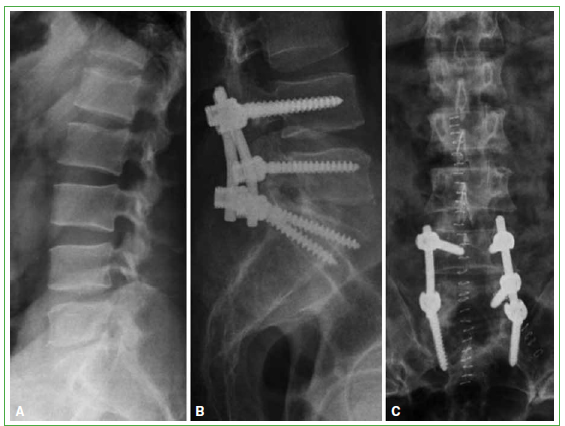
Figura 6. A. Radiografía de columna lumbar lateral. No se observan lesiones óseas. B y C. Radiografía de columna
lumbar. Se aprecia la instrumentación posterior corta de L4-L5-S1. (Abril de 2011).
El paciente evoluciona de manera favorable. El control a las tres semanas indica M5 en L3-L5 y M4 en S1. Los
antinflamatorios no esteroides disminuyen significativamente el dolor.
En los controles en policlínico, continúa con disminución de fuerza en L5-S1 a derecha asociada a hipoestesia de
las mismas metámeras. En 2014, comienza con un cuadro sintomático compatible con síndrome de cauda equina,
con pérdida del control de esfínter urinario, por lo que se repite la resonancia magnética de columna lumbar que revela
recidiva de lesiones de gran tamaño, a nivel lumbar intrarraquídeo. Se mantiene una conducta expectante y se reinicia albendazol 400 mg, cada 12 h, en ciclos de 2 meses, seguidos de 2 meses de descanso y control de pruebas
hepáticas; la sintomatología cede (Figura 7). En la actualidad, no tiene compromiso de cauda equina, pero sufre
una radiculopatía a nivel de L5 y S1 a derecha, como secuela, con adecuado control de esfínteres. Se mantiene la
administración de albendazol en ciclos continuos de 2 meses, seguido de 2 meses de descanso.
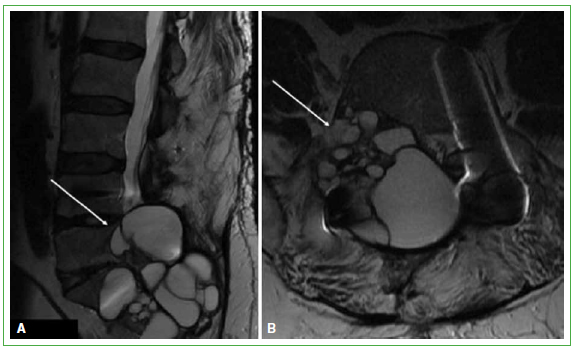
Figura 7. Resonancia magnética de columna lumbar. A y B. Cortes sagital y transversal. Se observan múltiples lesiones
quísticas en relación con L4-L5 y S1, con compromiso intrarraquídeo. (Mayo de 2014).
Discusión
En la hidatidosis, el compromiso óseo es raro, no supera el 2,5% de los pacientes con esta enfermedad. En pacientes
con hidatidosis con compromiso óseo, la edad promedio de diagnóstico es de 51 años y se presenta con el
doble de frecuencia en mujeres. Los sitios óseos predominantes son las vértebras (50%) y la cadera (30%).1 Cualquier
segmento de la columna vertebral puede estar comprometido, inclusive el torácico (50%), lumbar (20%),
sacro (20%) y cervical (10%). Los quistes pueden ser únicos o múltiples.5
La presentación clínica de la hidatidosis espinal es variable, incluye paraparesia (62%), paraplejia (26%), dolor
de espalda o dolor radicular (55%), hipoestesia o pérdida de la sensibilidad (36%) y alteraciones de los esfínteres
(30%).6,7 El diagnóstico es tardío, ya que el crecimiento es lento y asintomático. Los signos clínicos son inespecíficos,
y se caracterizan por dolor, aumento de volumen y fracturas de baja energía. También se puede manifestar
por compresión de órganos vecinos. Los quistes óseos se pueden romper espontáneamente y pueden producir una
reacción anafiláctica, fiebre y urticaria. El diagnóstico diferencial debe incluir tuberculosis, condrosarcoma, mieloma
múltiple, metástasis de tumor primario desconocido y tumor de células gigantes.8
Los estudios por imágenes y la serología pueden ser útiles para el diagnóstico. La radiografía, aunque inespecífica,
puede mostrar osteólisis multilocular con expansión del hueso, adelgazamiento cortical, áreas quísticas
radiolúcidas y esclerosis reactiva. La tomografía computarizada tiene una alta sensibilidad y especificidad, aunque
su principal utilidad es la planificación preoperatoria.3,9 Por su parte, la resonancia magnética es útil para evaluar
el compromiso de partes blandas que, si se confirma, indica un peor pronóstico.3 La serología mediante la prueba
de hemaglutinación indirecta por ELISA tiene una elevada especificidad (IgG), pero su sensibilidad es subóptima
en el compromiso extrahepático. Se debe evitar la punción aspirativa con aguja fina por el riesgo de diseminación.1
Braithwaite y Lees10 han clasificado el compromiso del canal medular en cinco tipos, desde el punto de vista
morfológico: 1) quistes hidatídicos intramedulares primarios, 2) intradurales extramedulares, 3) extradurales
intraespinales, 4) hidatidosis vertebral y 5) hidatidosis paravertebral. El compromiso intradural extramedular es
extremadamente raro, pero puede observarse principalmente en países y zonas endémicos. La destrucción ósea
ocurre por tres mecanismos: compresión, isquemia y proliferación osteoclástica alrededor del tejido comprimido.3
El cartílago articular y los discos intervertebrales no ofrecen resistencia al desarrollo del parásito.3
Los dos casos comunicados corresponden al tipo 3 de la clasificación de Braithwaite y Lees10.
La vía de propagación de la enfermedad a la columna vertebral todavía no está totalmente determinada. La hidatidosis
vertebral, por lo general, comienza en los cuerpos vertebrales y puede avanzar a cualquier nivel vertebral,
y alcanzar el canal medular o los discos intervertebrales. Se cree que el compromiso de la médula se produce a
través de la anastomosis venosa vertebral portal. Además, la enfermedad extradural puede propagarse a través del
foramen a los tejidos blandos que lo rodean. Los mecanismos para el compromiso extramedular e intradural aún no
están claros. La propagación hematógena primaria se considera como el mecanismo más factible. Otro mecanismo
propuesto es por contigüidad, mecanismo conocido para la diseminación bacteriana, pero no para los parásitos.11
La hidatidosis espinal tiene un mal pronóstico, la tasa de mortalidad es elevada (cerca del 50%), especialmente si
se asocia a paraplejia. El tiempo promedio de supervivencia es de 5 años.12 El tratamiento requiere resección amplia
y quimioterapia.1,13 Los procedimientos quirúrgicos son el tratamiento de elección para la compresión espinal
causada por quistes hidatídicos. La laminectomía con descompresión simple es el procedimiento más utilizado.13,14
No obstante, la escisión amplia es especialmente difícil en las vértebras y la pelvis por el compromiso de estructuras
críticas.1 Además, en resecciones extensas, los tiempos quirúrgicos pueden aumentar el riesgo de infección. La
tasa de recidiva tras el tratamiento quirúrgico solo oscila entre el 70% y el 80%.1,2 Los quistes deben ser extraídos
sin que se rompan; de lo contrario, se diseminan a tejidos contiguos.
El tratamiento farmacológico de la hidatidosis, cuando se combina con la cirugía, parece mejorar los resultados,
con tasas de éxito del 25-30% y de mejoría en un 40-50%. No parece tener ningún impacto en aproximadamente
un 25-30% de los casos.14 El albendazol y el mebendazol son los principales fármacos antihelmínticos administrados,
el primero está recomendado como terapia por la Organización Mundial de la Salud.14 Sin embargo, cuando
hay compromiso óseo, la respuesta ha sido menos favorable que en otros sitios. También se han empleado otros
agentes, como praziquantel y cimetidina, con resultados controversiales.15
A pesar del diagnóstico y el tratamiento médico-quirúrgico precoces, el pronóstico de la enfermedad hidatídica
ósea sigue siendo muy pobre, comparable incluso con el de una neoplasia maligna, con posibilidad latente de
recurrencias.
En conclusión, nuestros dos casos de hidatidosis vertebral con compromiso intrarraquídeo presentaron una clínica
larvada con compromiso neurológico progresivo. Requirieron tratamiento médico-quirúrgico con varias intervenciones
y ciclos de albendazol, con resultados clínicos favorables, pero transitorios, debido a las recurrencias
y con secuelas neurológicas. Además, la falta de adherencia al tratamiento perjudicó la evolución. El seguimiento
con estudio por imágenes, especialmente la resonancia magnética, resultó útil para evaluar las recidivas y planificar
nuevas intervenciones quirúrgicas.
En estos pacientes, los factores que jugaron en contra fueron la ruralidad y la escasa adherencia al tratamiento
con agentes antihelmínticos, la pérdida de los controles y el seguimiento, por lo que, en estos casos, no se pudo
realizar un tratamiento continuo y prolongado con albendazol, según lo indicado por el Servicio de Infectología.
Comunicamos estos dos casos complejos con el objetivo de compartir nuestra experiencia y recalcar la necesidad
de una sospecha diagnóstica, principalmente en zonas endémicas ganaderas.
Conflicto de intereses: Los autores no declaran conflictos de intereses.
Bibliografía
1. Herrera A, Martínez A. Extraspinal bone hydatidosis. J Bone Joint Surg Am 2003;85:1790-4. https://doi.org/10.2106/00004623-200309000-00019
2. Fica A, Soto A, Slater J, Peralta M, Humeres R, Casto M, et al. Quince años de experiencia clínica con hidatidosis.
Rev Chil Infectol 2012;29:183-91. http://dx.doi.org/10.4067/S0716-10182012000200011
3. Zlitni M, Ezzaouia K, Lebib H, Karray M, Kooli M, Mestiri M. Hydatid cyst of bone: diagnosis and treatment.
World J Surg 2001;25:75-82. https://doi.org/10.1007/s002680020010
4. Acosta-Jamett G, Vargas R, Ernst S. Caracterización epidemiológica de hidatidosis humana y animal en la Región
de Los Ríos, 1999-2009. Rev Chil Infectol 2016;33:419-27. http://dx.doi.org/10.4067/S0716-10182016000400006
5. Islekel S, Zileli M, Ersahin Y. Intradural spinal hydatid cysts. Eur Spine J 1998;7:162-4. https://doi.org/10.1007/s005860050048
6. Altinörs N, Bavbek M, Caner H, Erdogan B. Central nervous system hydatidosis in Turkey: a cooperative study and
literature survey analysis of 458 cases. J Neurosurg 2000;93:1-8. https://doi.org/10.3171/jns.2000.93.1.0001
7. Jamshidi M, Mohraz M, Zangeneh M, Jamshidi A. The effect of combination therapy with albendazole and
praziquantel on hydatid cyst treatment. Parasitol Res 2008;103:195-9. https://doi.org/10.1007/s00436-008-0954-z
8. Schneppenheim M, Jerosch J. Echinococcosis granulosus/cysticus of the tibia. Arch Orthop Trauma Surg 2003;123:
107-11. https://doi.org/10.1007/s00402-002-0461-0
9. Martínez A, Herrera A, Cuenca J, Herrero L. Hydatidosis of the pelvis and hip. Int Orthop 2001;25:302-4. https://doi.org/10.1007/s002640100278
10. Braithwaite P, Lees R. Vertebral hydatid disease. Radiological assessment. Radiology 1981;140:763-6. https://doi.org/10.1148/radiology.140.3.7280247
11. Kaen A, Lagares A, Perez Nuñez A. Intradural extramedullary spinal hidatidosis: case report. Neurocirugía 2009;20:
282-7. https://doi.org/10.1016/S1130-1473(09)70169-1
12. Ozdemir H, Ogun T, Tasbas B. A lasting solution is hard to achieve in primary hydatid disease of the spine. Spine
2004;29:932-7. https://doi.org/10.1097/00007632-200404150-00022
13. Yildiz Y, Bayrakci K, Altay M, Saglik Y. The use of polymethylmethacrylate in the management of hydatid disease
of bone. J Bone Joint Surg Br 2001;83:1005-8. https://doi.org/10.1302/0301-620x.83b7.12105
14. Wen H, Zhang HW, Muhumut M, Zou PF, Craig PS. Initial observation on albendazole in combination with
cimetidine for the treatment of human cystic echinococcosis. Ann Trop Med Parasitol 1994;88:49-52. https://doi.org/10.1080/00034983.1994.11812834
15. Song X, Ding L, Wen H. Bone hydatidic disease. Postgrad Med J 2007;83(982):536-42. https://doi.org/10.1136/pgmj.2007.057166